『應用篇』AAV在肺部應用中的靶向策略
上一期小V和大家一起學習了關于rAAV在肺部實驗中的啟動子、血清型以及注射方式的選擇策略(『干貨篇』AAV在肺部應用中的靶向策略),今天我們將和大家一起通過幾個具體案例深入了解一下關于AAV在肺部研究中的應用策略。
維真生物AAV注射(she)肺部(bu)案(an)例展示
1、“SERPINB10 contributes to asthma by inhibiting the apoptosis of allergenic Th2 cells”
原(yuan)文鏈接:
哮喘(Asthma)是由多種細胞(如嗜酸性粒細胞、肥大細胞、T淋巴細胞、中性粒細胞、氣道上皮細胞等)和細胞組分參與的慢性炎癥性疾病,常伴隨有氣道炎癥、氣道高反應性、大量粘液分泌和氣道重塑的特征。研究表明,輔助型T細胞2(Th2)及其分泌的細胞因子與哮喘發病機制密切相關;絲氨酸蛋白酶抑制劑家族成員SERPINB10與哮喘的過敏性炎癥有關,但其在過敏性哮喘Th2應答中的作用尚不清楚。
在本研究中,作者通過抑制小鼠SERPINB10表達(利用AAV6載體進行氣管內注射),發現屋塵螨(HDM)誘導的氣道炎癥和Th2反應有所緩解,HDM誘導的Th2細胞因子分泌和HDM特異性IgE水平顯著降低,且誘導了Th2的凋亡增加。本文揭示了SERPINB10通過抑制Th2細胞的凋亡促進哮喘的炎癥發生,闡明了SERPINB10在過敏性哮喘Th2反應中的重要作用。
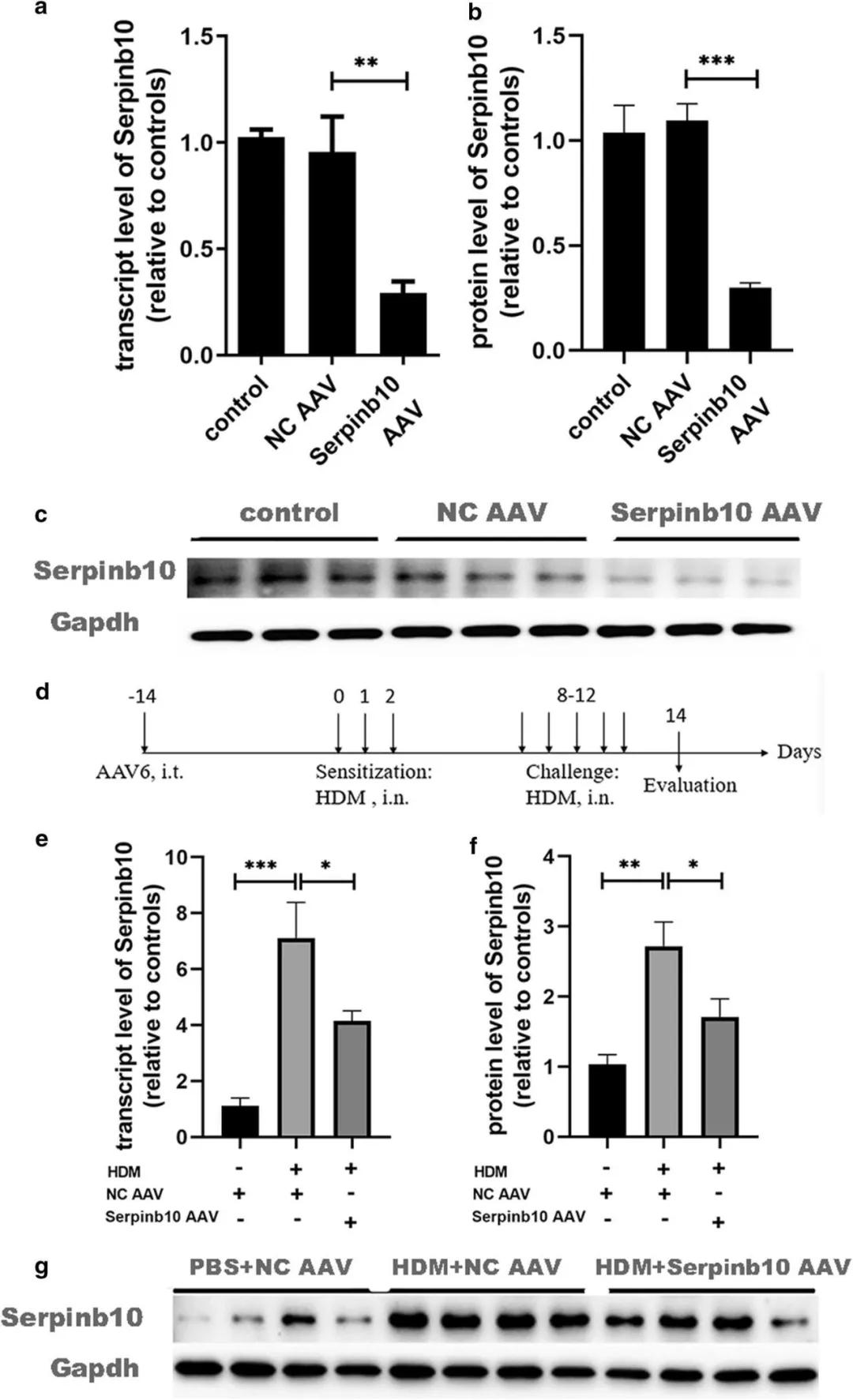
如圖1所示,研究人員通過HDM誘導構建了哮喘小鼠模型,借助AAV6下調SERPINB10的表達,結果發現小鼠肺組織中SERPINB10的轉錄水平和蛋白表達水平均顯著降低,干擾率約為74.2%。AAV6-SERPINB10 shRNA對于HMD誘導的SERPINB10高表達同樣可以起到很好的干擾效果,并表現為持久有效地抑制。
圖1. AAV6-Serpinb10shRNA干擾效率檢測
2、“circHIPK3 regulates lung fibroblast-tomyofibroblast transition by functioning as a competing endogenous RNA”
原文(wen)鏈接:
特發性肺纖維化(IPF)是一種慢性、進行性、纖維化性間質性肺疾病,發病機制尚不完全清楚,迫切需要新的靶向藥物來阻止其纖維化過程。肺內形成由肌成纖維細胞組成的纖維化灶和細胞外基質(ECM)蛋白的異常表達是IPF的顯著病理特征,而肌成纖維細胞主要來源于成纖維細胞轉化(FMT),因此,了解IPF中FMT過程的調控機制或許將會為IPF治療提供新的靶點。circHIPK3已被鑒定在肺中高表達,且在人成纖維細胞中富集。然而,circHIPK3是否參與介導成纖維細胞的生物學功能尚不清楚。
研究人員利用博萊霉素(BLM)制備IPF小鼠模型,探究了circHIPK3在肺纖維化中的作用,發現circHIPK3在肺纖維化小鼠模型,FMT衍生的肌成纖維細胞中表達上調;沉默circHIPK3(通過AAV6載體進行氣管內注射)可以在體內外抑制成纖維細胞增殖并改善FMT。從機制上來講,circHIPK3作為內源性miR-338-3p的海綿調控FMT:circHIPK3通過抑制miR-338-3p活性導致FMT調控因子SOX4和COL1A1表達增加。總的來說,circHIPK3的干預可能為肺纖維化的治療提供新的見解。
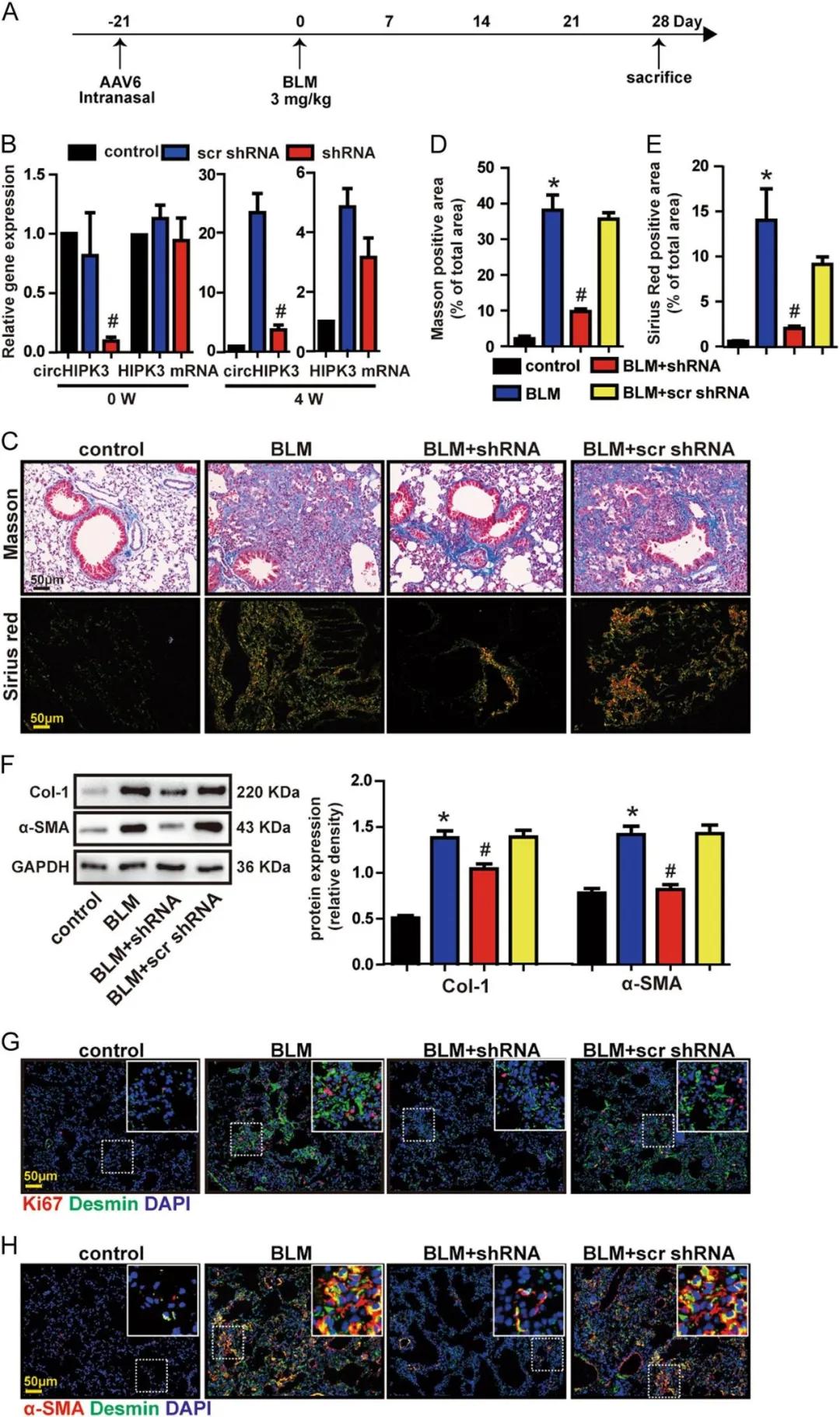
如圖2所示,通過氣管內注射AAV6-circHIPK3 shRNA顯(xian)著降(jiang)低了circHIPK3在肺(fei)中的(de)表達(da),沉默(mo)circHIPK3后減弱了BLM誘(you)導的(����de)肺(fei)纖維(wei)(wei)化(hua)小鼠中的(de)膠原沉積(ji),并降(jiang)低了肌(ji)成纖維(wei)(wei)細胞標記物α-SMA和Col-1的(de)表達(da)水平。這些結(jie)果表明(ming),circHIPK3沉默(mo)顯(xian)著改善了BLM誘(you)導的(de)肺(fei)纖維(wei)(wei)化(hua),抑制肺(fei)成纖維(wei)(wei)細胞增殖(zhi)。
圖2. circHIPK3沉默可減輕BLM誘導的肺纖維化并改善體內成纖維細胞功能障礙
3、“Sirtuin 6 inhibits epithelial to mesenchymal transition during idiopathic pulmonary fibrosis via inactiva������ting TGF-β1/Smad3 signaling”。
原文鏈接(jie):
特發(fa)(fa)性(xing)肺(fei)纖(xian)維(wei)(wei)(wei)化(hua)(hua)(hua)(IPF)是一(yi)(yi)種不可逆、進行性(xing)、平(ping)均生存期短的(de)(de)(de)(de)間(jian)質(zhi)性(xing)肺(fei)疾病,其(qi)特征是細胞外基質(zhi)(ECM)過度沉積(ji)和肺(fei)結構受損,目前(qian)尚無有(you)效(xiao)的(de)(de)(de)(de)治(zhi)療(liao)方法,迫(po)切需要從(cong)機制上(shang)了(le)(le)解(jie)其(qi)發(fa)(fa)病機制,以(yi)開發(fa)(fa)治(zhi)療(liao)這一(yi)(yi)疾病的(de)(de)(de)(de)新(xin)方法。目前(qian)已發(fa)(fa)現(xian)上(shang)皮(pi)向(xiang)間(jian)質(zhi)轉(zhuan)化(hua)(hua)(hua)(EMT)參(can)與了(le)(le)特發(fa)(fa)性(xing)肺(fei)纖(xian)維(wei)(wei)(wei)化(hua)(hua)(hua)的(de)(de)(de)(de)發(fa)(fa)病機制,確定調節EMT或將間(jian)充質(zh������i)�����細胞去分(fen)化(hua)(hua)(hua)為上(shang)皮(pi)細胞的(de)(de)(de)(de)關鍵(jian)分(fen)子是抑制或逆轉(zhuan)IPF的(de)(de)(de)(de)一(yi)(yi)種有(you)吸引力的(de)(de)(de)(de)治(zhi)療(liao)策略。SIRT6參(can)與控(kong)制衰老(lao)、癌(ai)癥(zheng)和新(xin)陳代(dai)謝,已被證明在心(xin)臟(zang)和肝(gan)臟(zang)具有(you)抗纖(xian)維(wei)(wei)(wei)化(hua)(hua)(hua)功能。然而,SIRT6是否參(can)與肺(fei)EMT,抑制特發(fa)(fa)性(xing)肺(fei)纖(xian)維(wei)(wei)(wei)化(hua)(hua)(hua)(IPF)尚不清楚(chu)。
在本研(yan)(yan)究(jiu)中,研(yan)(yan)究(jiu)人(ren)員首先通過(guo)體(ti)外研(yan)(yan)究(jiu)發現(xian),在TGF-β1誘(you)導的A549細胞中Sirt6表(biao)達(da)上(shang)調(diao),且過(guo)表(biao)達(da)Sirt6可負調(diao)控EMT進(jin)程(cheng),EMT相關(guan)轉錄(lu)因子的表(biao)達(da)和間充(chong)質細胞行為。隨后(hou)通過(guo)體(ti)內(nei)研(yan)����(yan)究(jiu)表(biao)明,通過(guo)AAV載體(ti)使Sirt6在小鼠(shu)肺部成功表(biao)達(da),可以消除(chu)博(bo)萊(lai)霉素(su)(BLM)誘(you)導的EMT樣(yang)表(biao)型和肺纖維化(hua),揭示了Sirt6在肺EMT過(guo)程(cheng)中的關(guan)鍵(jian)作用(yong),并(bing)可能成為特(te)發性(xing)肺纖維化(hua)的一個(ge)潛在治�����療(liao)靶點。
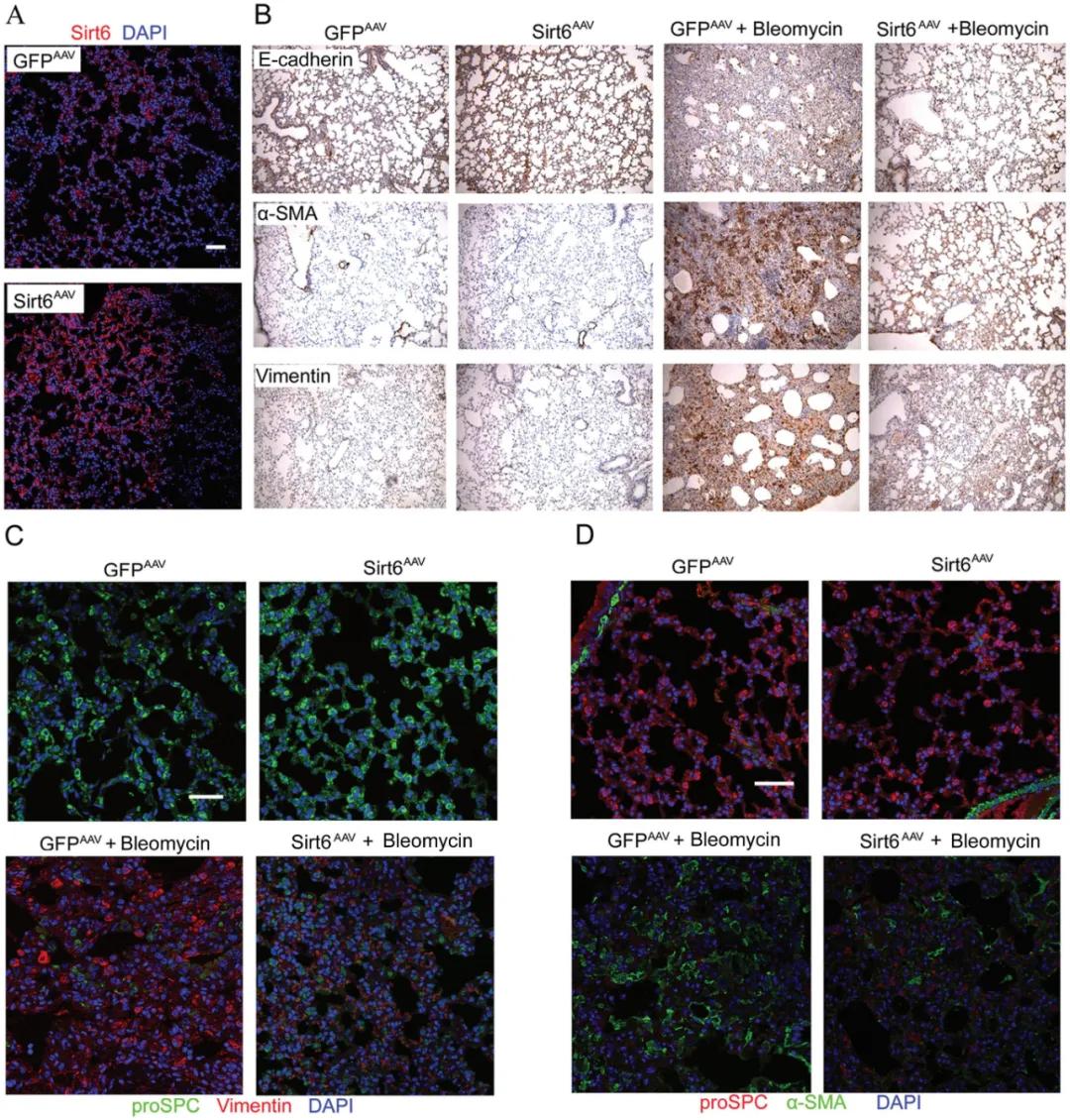
如(ru)圖3所示,通過氣(qi)管內注(zhu)射AAV-�����Sirt6后(hou),Sirt6在(zai)肺(fei)泡(pao)壁成功表達(da),Sirt6過表達(da)明顯消除(chu)了(le)博來霉素誘(you)導(dao)的EMT表型(xing)并緩解了(le)肺(fei)纖(xian)維化(hua)。
圖3. AAV-Sirt6可改善博萊霉素誘導的肺EMT
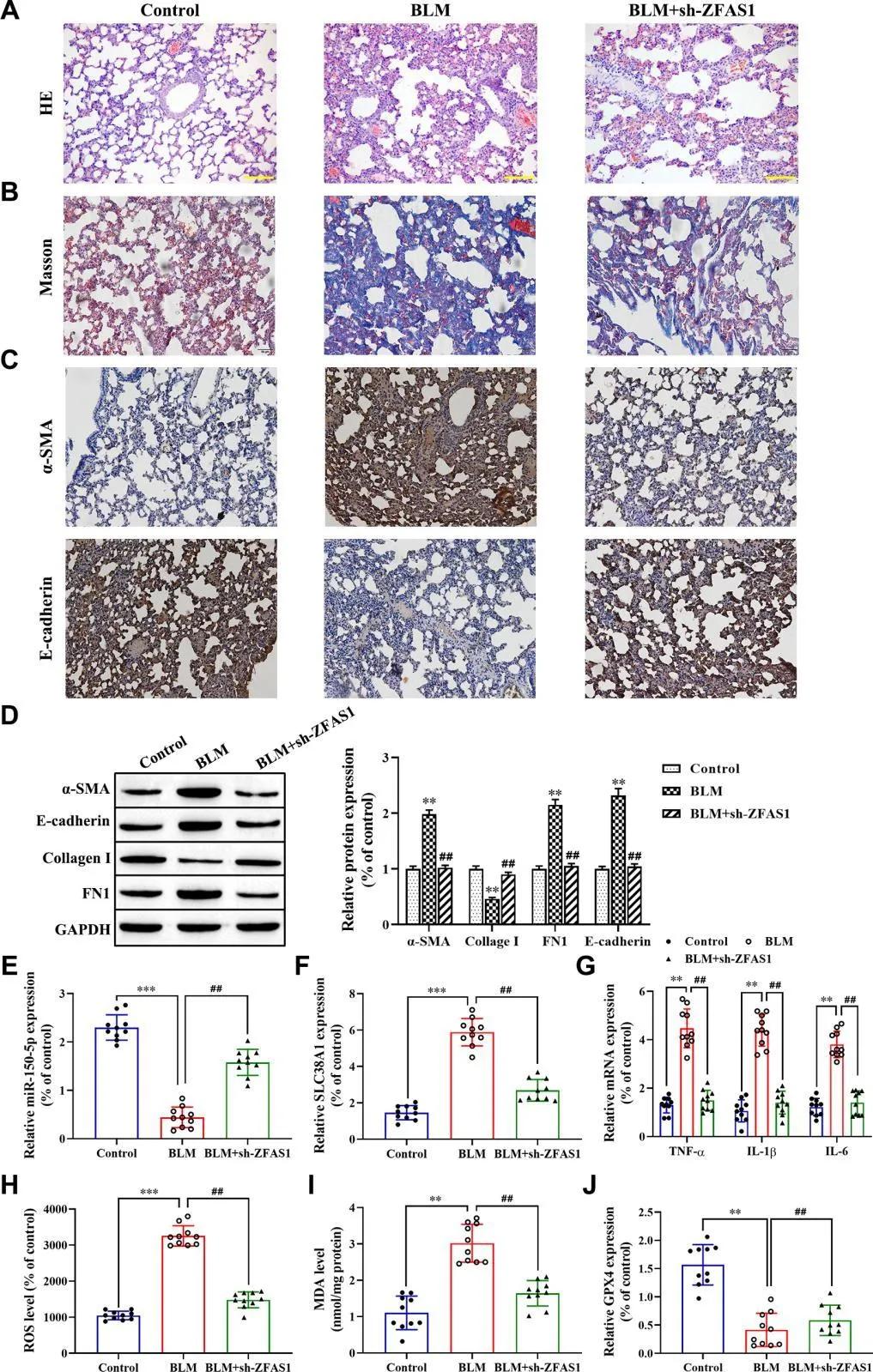
4、“lncRNA ZFAS1 promotes lung fibroblast-to-myofibroblast transition a������nd ferroptosis via functioning as a ceRNA thro�������ugh miR-150- 5p/SLC38A1 axis”。
原文(wen)鏈(lian)接(jie):
越來(lai)越多(duo)的(de)(de)(de)證據表明,lncRNA參(can)與了(le)肺(fei)纖維化(PF)的(de)(de)(de)多(duo)種病理(li)生理(li)過(guo)程(cheng),其中lncRNA ZFAS1被報������(bao)道可能參(can)與了(le)PF進(jin)展,但其作(zuo)(zuo)用(yong)及機(ji)制有(you)待進(jin)一(yi)步闡明。在本研究(jiu)中,作(zuo)(zuo)者發現(xian)lncRNA ZFAS1在博萊(lai)霉素(BLM)誘導的(de)(de)(de)PF大鼠肺(fei)組織和TGF-β1處理(li)的(de)(de)(de)HFL1細胞(bao)中表達上調(diao),并與脂質過(guo)氧化的(de)(de)(de)重要調(diao)節因(yin)子(zi)SLC38A1的(de)(de)(de)表達呈正相(xiang)關。此(ci)外(wai),lncRNA ZFAS1的(de)(de)(de)體內外(wai)敲低(di)實驗表明,干擾lncRNA ZFAS1的(de)(de)(de)表達可以(yi)抑制BLM誘導的(de)(de)(de)脂質過(guo)氧化和PF的(de)(de)(de)形成(cheng),伴(ban)隨(sui)SLC38A1的(de)(de)(de)下調(diao)。最(zui)后,作(zuo)(zuo)者揭示了(le)lncRNA ZFAS1/miR-150-5p/SLC38A1通路(lu)在PF進(jin)展中的(de)(de)(de)作(zuo)(zuo)用(yong),這可能為(wei)PF患者的(de)(de)(de)治療提供新的(de)(de)(de)靶點。
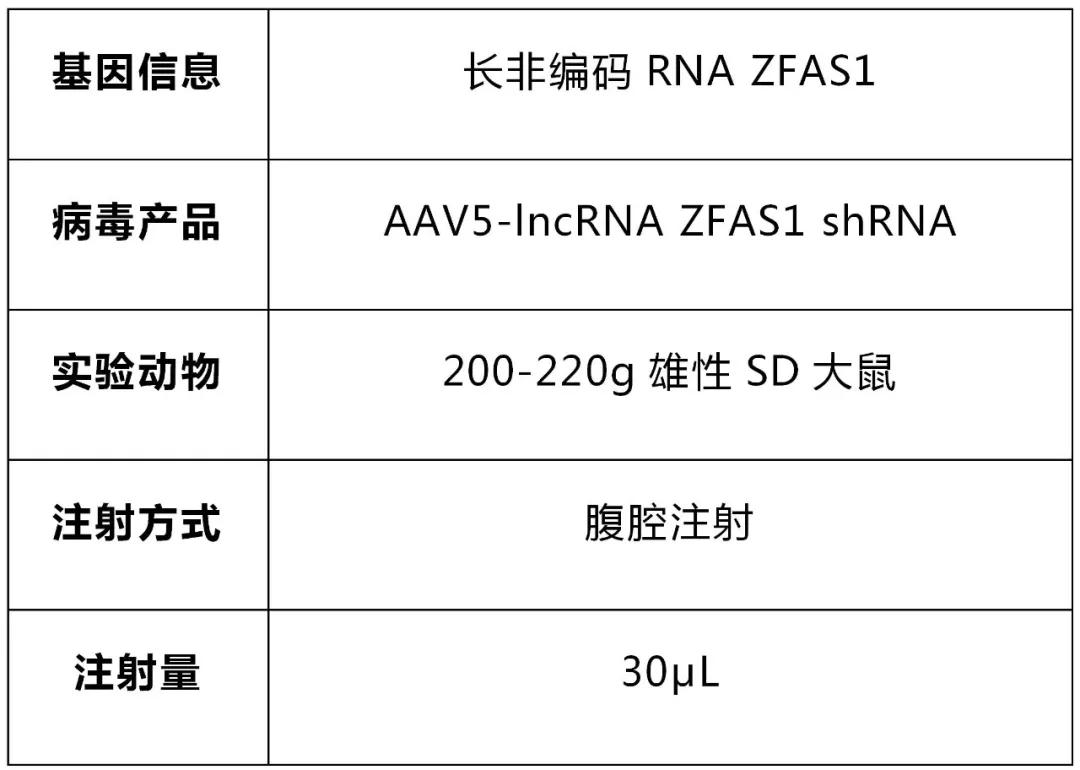
腹腔(qiang)注射表(biao)達(da)(da)lncRNA ZFAS1 的(de)(de)(de)AAV5敲低(di)載體后(hou),明顯(xian)減弱了(le)(le)BLM誘(you)導的(de)(de)(de)肺(fei)纖������維化(hua)特征。此外(wai),lncRNA ZFAS1的(de)(de)(de)敲低(di)顯(xian)著(zhu)增(zeng)加了(le)(le)BLM誘(you)導的(de)(de)(de)PF大(da)鼠模型肺(fei)組織中miR-150-5p的(de)(de)(de)表(biao)達(da)(da),并降低(di)了(le)(le)SLC38A1 mRNA的(de)(de)(de)表(biao)達(da)(da),同時(shi)減弱了(le)(le)BLM誘(you)導的(de)(de)(de)炎性因子的(de)(de)(de)表(biao)達(da)(da)、脂質過氧化(hua)和(he)鐵死(si)(si)亡。總(zong)的(de)(de)(de)來說,lncRNA ZFAS1的(de)(de)(de)下調通過調節(jie)miR-150-5p/SL�����C38A1通路(lu)顯(xian)著(zhu)減弱BLM誘(you)導的(de)(de)(de)肺(fei)纖維化(hua)和(he)鐵死(si)(si)亡(圖4)。
圖4. lncRNA ZFAS1敲低通過調控miR-150-5p/SLC38A1通路阻斷BLM誘導的PF
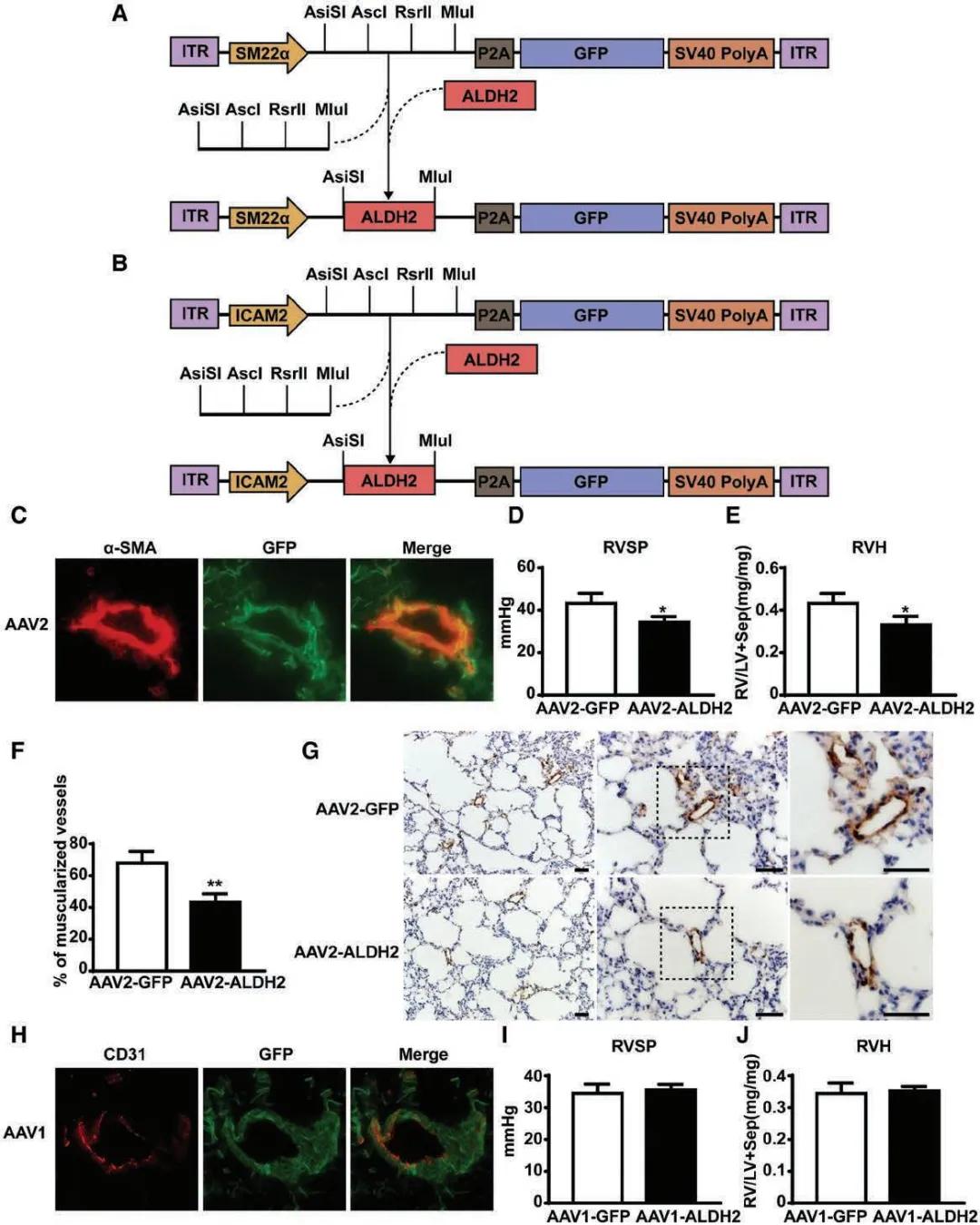
5、“ALDH2 (Aldehyde Dehydrogenase �������2) Protects Against Hypoxia-Induced Pulmona�����ry Hypertension”。
原文鏈接:
肺(fei)動(dong)脈(mo)高(gao)(gao)壓(pulmonary hypertension,PH)是(shi)由多種已知或未(wei)知原因引起(qi)的(de)(de)(de)(de)肺(fei)動(dong)脈(mo)壓異常(chang)升高(gao)(gao)的(�����de)(de)(de)(de)一(yi)種病理生(sheng)理狀態。缺氧(yang)性肺(fei)動(dong)脈(mo)高(gao)(gao)壓(HPH)是(shi)常(chang)見的(de)(de)(de)(de)PH類型,目前尚無有(you)效治療藥物,因此(ci),有(you)必要(yao)深(shen)入(ru)了解(jie������)HPH的(de)(de)(de)(de)潛(qian)在機制(zhi),以確定潛(qian)在的(de)(de)(de)(de)新治療靶點。HPH會導致肺(fei)動(dong)脈(mo)平滑肌細胞PASMCs過度增(zeng)殖(zhi),并促進脂(zhi)質過氧(yang)化,產生(sheng)包(bao)括4-羥基(ji)壬烯醛(4-HNE)等在內的(de)(de)(de)(de)有(you)毒醛。有(you)研(yan)究(jiu)表明(ming),醛脫氫酶2(ALDH2)作(zuo)為重(zhong)要(yao)的(de)(de)(de)(de)醛類解(jie)毒酶,可通過清除脂(zhi)質過氧(yang)化產生(sheng)的(de)(de)(de)(de)有(you)毒醛,特別是(shi)4-HNE,能(neng)在心肌損(sun)傷和(he)中風中起(qi)保護作(zuo)用,且ALDH2的(de)(de)(de)(de)激活(huo)可以緩解(jie)野百(bai)合(he)堿誘導的(de)(de)(de)(de)肺(fei)動(dong)脈(mo)高(gao)(gao)壓,盡管如此(ci),ALDH2在HPH中的(de)(de)(de)(de)作(zuo)用及其潛(qian)在機制(zhi)尚未(wei)被充(chong)分研(yan)究(jiu)。
為了確定ALDH2 在HPH的(de)(de)作用, 研究(jiu)人員(yuan)以ALDH2轉基因小鼠(shu)、C57BL/6J小鼠(shu),和(he)ALDH2基因敲除(ALDH2?/?)小鼠(shu)為實驗對象,將其暴露在慢性(xing)缺氧(yang)環(huan)境中(zhong),發(fa)現(xian)慢性(xing)缺氧(yang)促(cu)進了肺(fei)組織(zhi)(zhi)中(zhong)4-HNE的(de)(de)產生(sheng),HPH小鼠(sh��������u)肺(fei)組織(zhi)(zhi)中(zhong)ALDH2表達下(xia)調。隨(sui)后通過多(duo)種途徑證明ALDH2的(de)(de)激(ji)活可降(jiang)低4-HNE的(de)(de)水(shui)平,減輕(qing)HPH的(de)(de)發(fa)生(sheng)程度,并調控PA�������SMCs的(de)(de)增(zeng)殖和(he)遷移。

肺(fei)動脈(mo)平(ping)(ping)滑(hua)肌(ji)細(xi)(xi)胞(bao)和(he)內(nei)(nei)皮(pi)細(xi)(xi)胞(bao)在(zai)HPH的發(fa)生發(fa)展中(zhong)(zhong)發(fa)揮(hui)重(zhong)要作用,為確(que)定ALDH2通過(guo)哪(na)種細(x������i)(xi)胞������(bao)在(zai)HPH中(zhong)(zhong)發(fa)揮(hui)作用,研究(jiu)者利用AAV1 -ICAM2-ALDH2和(he)AAV2-SM22α-ALDH2分別(bie)在(zai)小鼠肺(fei)動脈(mo)內(nei)(nei)皮(pi)細(xi)(xi)胞(bao)和(he)平(ping)(ping)滑(hua)肌(ji)細(xi)(xi)胞(bao)中(zhong)(zhong)特(te)異(yi)性(xing)過(guo)表(biao)達ALDH2,發(fa)現尾(wei)靜脈(mo)注射AAV病毒后,平(ping)(ping)滑(hua)肌(ji)細(xi)(xi)胞(bao)或(huo)內(nei)(nei)皮(pi)細(xi)(xi)胞(bao)中(zhong)(zhong)均(jun)出(chu)現強(qiang)烈的GFP熒光信號(hao),且(qie)右(you)心室收(shou)縮壓RVSP、右(you)室肥厚指數RVH和(he)肺(fei)血管(guan)肌(ji)化的檢(jian)測結果表(biao)明(ming),在(zai)肺(fei)動脈(mo)平(ping)(ping)滑(hua)肌(ji)細(xi)(xi)胞(bao)而(er)非內(nei)(nei)皮(pi)細(xi)(xi)胞(bao)中(zhong)(zhong)特(te)異(yi)性(xing)過(guo)表(biao)達ALDH2可抑制HPH的發(fa)生(圖(tu)5)。
圖5. 肺動脈平滑肌細胞(而非內皮細胞)中過表達ALDH2可抑制HPH的發生
 當前位置:首頁 > 研究領域 > 其他
當前位置:首頁 > 研究領域 > 其他